
Samenvatting: Toezichthouders keuren Impella 5.5 met SmartAssist goed in Japan en Hongkong; US FDA verleent voorwaardelijke IDE-goedkeuring voor Impella BTR voor eerste-humanstudie naar vroege haalbaarheid
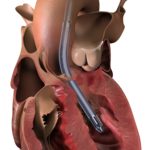
DANVERS, Mass.--(BUSINESS WIRE)--Regelgevers in drie landen hebben goedkeuringen verleend voor chirurgische producten van Impella, aangezien Abiomed (NASDAQ: ABMD) zijn strategie voor duurzame groei blijft uitvoeren met nieuwe producten, nieuwe indicaties en nieuwe geografische gebieden. In de Verenigde Staten heeft de Food en Drug Administration (FDA) een Early Feasibility Study (EFS) Investigational Device Exemption (IDE) toegekend aan Impella BTR (Bridge-to-Recovery). In Azië heeft Impella 5.5 met SmartAssist goedkeuring gekregen van de Japanse Pharmaceuticals and Medical Devices Agency (PMDA) en de Medical Device Division (MDD) van Hong Kong.

Deze bekendmaking is officieel geldend in de originele brontaal. Vertalingen zijn slechts als leeshulp bedoeld en moeten worden vergeleken met de tekst in de brontaal, die als enige rechtsgeldig is.
Contacts
For further information please contact:
Media Contact:
Tom Langford
Director of Communications
+1 (978) 882-8408
tlangford@abiomed.com
Investor Contact:
Todd Trapp
Vice President and Chief Financial Officer
+1 (978) 646-1680
ttrapp@abiomed.com
Editor Details
-
Company:
- Businesswire
